Prix de ENANTONE LP 30 mg, poudre et solvant pour suspension injectable (S.C.) à libération prolongée en seringue-pré-remplie
-
Enantone lp 30mg poudre + solvant pr susp inj 1
P
Prix : 462,05€ Taux de remboursement : 100%
- Médicaments à base de Leuproréline : retour d'information sur le PRAC de juin 2019 - Point d'Information
- Leuproréline injectable (Eligard, Enantone LP, Leptoprol) : injections à réaliser exclusivement par des professionnels de santé ayant une bonne connaissance des étapes de reconstitution/administration - Point d'Information
- Leuproréline et erreurs de manipulation ; traitements hormonaux substitutifs (THS) et risque de cancer du sein : retour d'information sur le PRAC de mai 2020
ANSM - Mis à jour le : 24/02/2023
ENANTONE LP 30 mg, poudre et solvant pour suspension injectable (S.C.) à libération prolongée en seringue pré-remplieAcétate de leuproréline Veuillez lire attentivement cette notice avant d'utiliser ce médicament car elle contient des informations importantes pour vous.· Gardez cette notice. Vous pourriez avoir besoin de la relire.
· Si vous avez d'autres questions, interrogez votre médecin, votre pharmacien ou votre infirmier/ère.
· Ce médicament vous a été personnellement prescrit. Ne le donnez pas à d'autres personnes. Il pourrait leur être nocif, même si les signes de leur maladie sont identiques aux vôtres.
· Si vous ressentez un quelconque effet indésirable, parlez-en à votre médecin, votre pharmacien ou votre infirmier/ère. Ceci s'applique aussi à tout effet indésirable qui ne serait pas mentionné dans cette notice. Voir rubrique 4.
1. Qu'est-ce que ENANTONE LP 30 mg, poudre et solvant pour suspension injectable (S.C.) à libération prolongée en seringue pré-remplie et dans quels cas est-il utilisé ?
2. Quelles sont les informations à connaître avant d'utiliser ENANTONE LP 30 mg, poudre et solvant pour suspension injectable (S.C.) à libération prolongée en seringue pré-remplie ?
3. Comment utiliser ENANTONE LP 30 mg, poudre et solvant pour suspension injectable (S.C.) à libération prolongée en seringue pré-remplie ?
4. Quels sont les effets indésirables éventuels ?
5. Comment conserver ENANTONE LP 30 mg, poudre et solvant pour suspension injectable (S.C.) à libération prolongée en seringue pré-remplie ?
6. Contenu de l'emballage et autres informations.
Classe pharmacothérapeutique : ANALOGUE DE L'HORMONE ENTRAINANT LA LIBERATION DE GONADOTROPHINES - code ATC : L02AE02
Qu'est-ce que ENANTONE LP 30 mgAnalogue de l'hormone entrainant la libération de gonadotrophines.
Dans quels cas est-il utilisé ?Il est utilisé chez l'homme dans certaines maladies de la prostate et des os, seul ou associé à des rayons (radiothérapie).
N'utilisez jamais ENANTONE L.P. 30 mg, poudre et solvant pour suspension injectable (S.C.) à libération prolongée en seringue pré-remplie :·si vous êtes allergique (hypersensible) à la leuproréline, aux dérivés ou aux analogues de la GnRH ou à l'un des autres composants contenus dans ce médicament, mentionnés dans la rubrique 6.
Avertissements et précautionsFaites attention avec ENANTONE L.P. 30 mg, poudre et solvant pour suspension injectable (S.C.) à libération prolongée en seringue pré-remplie :Des cas de dépression, pouvant être sévère ont été rapportés chez des patients traités par ENANTONE LP 30 mg, poudre et solvant pour suspension injectable (SC) à libération prolongée en seringue pré-remplie.
Si vous prenez ENANTONE LP 30 mg, poudre et solvant pour suspension injectable (SC) à libération prolongée en seringue pré-remplie et si vous ressentez une humeur dépressive, parlez-en à votre médecin.
Veuillez signaler à votre médecin si vous souffrez du cur ou des vaisseaux, y compris si vous avez des troubles du rythme (arythmies) ou si vous êtes traités par des médicaments pour ces problèmes. Le risque de troubles du rythme cardiaque peut être augmenté avec ENANTONE.
Lors de la mise en route d'un traitement par ENANTONE, des cas isolés d'aggravation des symptômes cliniques (en particulier des douleurs osseuses), le plus souvent transitoires, ont été observés.
Une surveillance attentive sera effectuée pendant les premières semaines de traitement et une consultation médicale sera demandée rapidement devant toute aggravation des symptômes.
Des cas de convulsions ont été rapportés chez les patients traités par ENANTONE LP 30 mg poudre et solvant après sa mise sur le marché. Ces convulsions ont été observées chez les adultes avec ou sans antécédents, troubles, ou facteurs de risque liés aux convulsions.
Demandez conseil à votre médecin ou à votre pharmacien avant de prendre tout médicament.
Si vous souffrez de maux de tête intenses ou récurrents, de problèmes de vue et de sifflements ou bourdonnements dans les oreilles, contactez votre médecin immédiatement.
Prendre des précautions particulières avec ENANTONE L.P. 30 mg, poudre et solvant pour suspension injectable (S.C.) à libération prolongée en seringue pré-remplie :Ce médicament doit être utilisé sous surveillance médicale.
Votre médecin surveillera votre taux sanguin de sucre régulièrement car ENANTONE peut modifier votre métabolisme et donc votre taux sanguin de sucre.
Votre médecin doit s'assurer de la surveillance de votre densité osseuse et peut vous prescrire un traitement approprié car l'utilisation de ce médicament peut entraîner une diminution de la densité osseuse, une ostéoporose (fragilisation des os) et un risque accru de fractures osseuses.
Demandez conseil à votre médecin ou à votre pharmacien avant de prendre tout médicament.
Autres médicaments et ENANTONE L.P. 30 mg, poudre et solvant pour suspension injectable (S.C.) à libération prolongée en seringue pré-remplieVeuillez indiquer à votre médecin ou à votre pharmacien si vous prenez ou avez pris récemment un autre médicament, même s'il s'agit d'un médicament obtenu sans ordonnance.
D'autres médicaments et ENANTONE peuvent interagir avec les médicaments utilisés pour traiter les problèmes de rythme cardiaque (par exemple quinidine, procainamide, amiodarone et sotalol) ou peuvent augmenter le risque de troubles du rythme quand ils sont utilisés avec d'autres médicaments (par exemple méthadone (utilisé pour le traitement de la douleur et en désintoxication de l'addiction médicamenteuse, moxifloxacine (un antibiotique), antipsychotiques utilisés pour les maladies mentales graves).
ENANTONE L.P. 30 mg, poudre et solvant pour suspension injectable (S.C.) à libération prolongée en seringue pré-remplie avec des aliments, boissons et de l'alcoolSans objet.
Grossesse, allaitement et fertilitéDemandez conseil à votre médecin ou à votre pharmacien avant de prendre tout médicament.
SportifsSans objet.
Conduite de véhicules et utilisation de machinesLes effets d'ENANTONE L.P. 30 mg sur l'aptitude à conduire des véhicules et à utiliser des machines n'ont pas été étudiés. Une fatigue, une faiblesse musculaire et des troubles du sommeil peuvent survenir au cours de votre maladie ou de votre traitement. Si vous ressentez l'un de ces effets, vous devez être prudent si vous conduisez ou utilisez des machines.
Ce médicament contient moins de 1 mmol (23 mg) de sodium par dose, c'est-à-dire qu'il est essentiellement « sans sodium ».
ENANTONE LP 30 mg doit être uniquement administré par votre médecin ou un(e) infirmier(e). Ce sont eux qui seront chargés de préparer le produit.
La dose habituelle est de 1 injection tous les 6 mois.
Ce médicament sera injecté sous la peau.
Le mode d'administration de ce médicament est également expliqué dans la partie réservée aux professionnels de santé (voir ci-après).
Durée du traitement :
Votre médecin vous dira pendant combien de temps vous devez utiliser ce médicament.
Si vous avez utilisé plus de ENANTONE L.P. 30 mg, poudre et solvant pour suspension injectable (S.C.) à libération prolongée en seringue pré-remplie que vous n'auriez dû :Demandez conseil à votre médecin ou votre pharmacien.
Si vous oubliez d'utiliser ENANTONE L.P. 30 mg, poudre et solvant pour suspension injectable (S.C.) à libération prolongée en seringue pré-remplie :Ne prenez pas de dose double pour compenser la dose simple que vous avez oublié de prendre.
Si vous avez d'autres questions sur l'utilisation de ce médicament, demandez plus d'informations à votre médecin ou à votre pharmacien.
4. QUELS SONT LES EFFETS INDESIRABLES EVENTUELS ?
Ces effets indésirables décrits ci-après peuvent survenir même si l'effet du traitement est favorable.
Cependant, vous devez avertir immédiatement votre médecin traitant si l'un de ces effets survient.
Lors de la mise en route du traitement :En début de traitement, une aggravation des effets et des symptômes pour lesquels vous êtes traité peut survenir (et en particulier des douleurs osseuses).
Quelques personnes qui avaient :
- du sang dans leur urine,
- une difficulté à uriner (obstruction des voies urinaires),
- des sensations de faiblesse ou des sensations anormales au niveau des jambes,
ont ressenti une aggravation de ces symptômes lorsqu'ils ont pris un médicament de la même famille qu'ENANTONE.
Ces aggravations sont habituellement temporaires et disparaissent après 1 ou 2 semaines de traitement.
Vous devez néanmoins prévenir votre médecin si vous ressentez une aggravation de ces symptômes et notamment si vous avez des difficultés à uriner ou si vous avez un risque de maladie des nerfs et/ou du cerveau.
Pendant le traitementLes effets indésirables suivants peuvent survenir :
· Effets très fréquents (peuvent affecter plus de 1 personne sur 10) :
odes bouffées de chaleur,
odes douleurs osseuses,
oune diminution de la libido, une impuissance, une diminution de la taille des testicules,
odes troubles urinaires,
oune douleur, une réaction, une rougeur, des démangeaisons ou un gonflement au point d'injection. Ces effets diminuent généralement lors de la poursuite du traitement,
odes sueurs,
oune prise de poids.
· Effets fréquents (peuvent affecter jusqu'à 1 personne sur 10) :
oune diminution ou une perte de l'appétit (anorexie),
oune altération de l'humeur et une dépression (à long terme),
odes maux de tête,
odes nausées,
odes douleurs articulaires, une faiblesse musculaire,
oune augmentation du volume des seins,
oune fatigue, un gonflement des extrémités (bras et jambes), des fourmillements, des troubles du sommeil,
oune diminution du nombre de globules rouges,
oune augmentation de certaines enzymes,
oune fonction hépatique anormale.
· Effets peu fréquents (peuvent affecter jusqu'à 1 personne sur 100) :
o Allergie : des réactions allergiques généralisées peuvent apparaître. Vous reconnaitrez les signes d'une allergie par de la fièvre, des démangeaisons, une augmentation du taux de certains globules blancs (les éosinophiles) et des boutons et/ou des plaques rouges. Si une allergie survient, vous devez arrêter le traitement et contacter immédiatement un médecin.
odes diarrhées,
odes vomissements,
oune sécheresse de la peau ou des muqueuses (à l'intérieur du nez, de la bouche et/ou les parties génitales),
odes douleurs des testicules,
odes douleurs musculaires,
oune perte de poids,
oune dépression (à court terme).
· Effets rares (peuvent affecter jusqu'à 1 personnes sur 1 000) :
oune diminution ou une augmentation du taux de glucose dans le sang,
oune sensation de malaise, une altération temporaire du goût,
oune baisse ou une augmentation de la tension artérielle (hypotension ou hypertension),
oune chute des cheveux ou des poils.
· Effets très rares (concernent moins de 1 personne sur 10 000) :
oun arrêt du fonctionnement d'une glande du cerveau, l'hypophyse (apoplexie hypophysaire) chez des patients présentant une hypophyse de taille augmentée : si vous avez une lésion hypophysaire préexistante, il peut y avoir une augmentation du risque d'hémorragie dans cette région, pouvant provoquer des maux de tête violents, des troubles visuels et des troubles de la conscience nécessitant une prise en charge en urgence.
oréaction anaphylactique : réaction allergique grave pouvant se manifester par une urticaire, un choc allergique, un angidème (réaction allergique grave provoquant un gonflement du cou et du visage, gêne respiratoire).
· Effets de fréquence indéterminée (ne peut être estimée sur la base des données disponibles) :
oModification de l'ECG (allongement de l'intervalle QT),
oConvulsions,
oHypertension intracrânienne idiopathique (augmentation de la pression intracrânienne dans la zone du cerveau caractérisée par des maux de tête, une vision double et autres symptômes visuels et des sifflements ou bourdonnements dans une ou les deux oreilles),
oInflammation des poumons, maladie pulmonaire,
oIntolérance au glucose (élévation du taux de glucose dans le sang),
oTroubles visuels.
Variation de la densité des os :
Il est probable qu'un traitement à long terme par la leuproréline révèle des signes d'aggravation d'ostéoporose (fragilisation osseuse).
Déclaration des effets secondairesSi vous ressentez un quelconque effet indésirable, parlez-en à votre médecin, votre pharmacien ou à votre infirmier/ère. Ceci s'applique aussi à tout effet indésirable qui ne serait pas mentionné dans cette notice. Vous pouvez également déclarer les effets indésirables directement via le système national de déclaration : Agence nationale de sécurité du médicament et des produits de santé (ANSM) et réseau des Centres Régionaux de Pharmacovigilance - Site internet: https://signalement.social-sante.gouv.fr/
En signalant les effets indésirables, vous contribuez à fournir davantage d'informations sur la sécurité du médicament.
Tenir ce médicament hors de la vue et de la portée des enfants.
N'utilisez pas ce médicament après la date de péremption indiquée sur l'emballage. La date de péremption fait référence au dernier jour de ce mois.
A conserver à une température ne dépassant pas 25°C.
A conserver dans l'emballage extérieur d'origine, à l'abri de la lumière.
Ne jetez aucun médicament au tout-à-l'égout ou avec les ordures ménagères. Demandez à votre pharmacien d'éliminer les médicaments que vous n'utilisez plus. Ces mesures contribueront à protéger l'environnement.
6. CONTENU DE L'EMBALLAGE ET AUTRES INFORMATIONS
- La substance active est :
Acétate de leuproréline..................................................................................................... 30 mg
Equivalent à leuproréline base...................................................................................... 28,58 mg
Pour une seringue pré-remplie.
- Les autres composants sont :
o Poudre : Acide polylactique, mannitol.
o Solvant : Carmellose sodique, mannitol, polysorbate 80, eau pour préparations injectables.
Ce médicament se présente sous forme de poudre et de solvant pour suspension injectable (S.C.) à libération prolongée en seringue pré-remplie.
Chaque boîte contient 1 seringue pré-remplie.
Titulaire de l'autorisation de mise sur le marché
TAKEDA FRANCE SAS112 AVENUE KLEBER75116 PARISExploitant de l'autorisation de mise sur le marché
TAKEDA FRANCE SAS112 AVENUE KLEBER75116 PARIS DELPHARM NOVARA S.R.L.VIA CROSA, 86
28065 CERANO (NO)
ITALIE
Noms du médicament dans les Etats membres de l'Espace Economique Européen
[à compléter ultérieurement par le titulaire]
La dernière date à laquelle cette notice a été révisée est :
[à compléter ultérieurement par le titulaire]
Sans objet.
Des informations détaillées sur ce médicament sont disponibles sur le site Internet de l'ANSM (France).
Les informations suivantes sont destinées exclusivement aux professionnels de santé :
PosologieUne injection toutes les 26 semaines (6 mois).
Mode et voie d'administrationVoie sous-cutanée.
Mode d'utilisationCe produit doit être préparé, reconstitué et administré uniquement par des professionnels de santé familiarisés avec ces procédures.
Avertissements
Se laver les mains avant d'ouvrir l'emballage de la seringue.
Tenir la seringue en position verticale (aiguille tournée vers le haut) pendant toute la durée de la préparation pour éviter les fuites.
Utilisez le mélange immédiatement après reconstitution car la suspension forme un dépôt très rapidement après la reconstitution.
Vérifiez la date de péremption imprimée sur l'étiquette de la seringue, vérifiez la poudre et le diluant dans le cylindre de la seringue. La poudre doit être blanche et sèche, le diluant doit être transparent. Inspectez la seringue pour vérifier qu'elle n'est pas endommagée.
· Ne pas utiliser la seringue si la date de péremption est dépassée.
· Ne pas utiliser la seringue si la poudre semble agglutinée ou collée.
· Ne pas utiliser la seringue si la poudre ou le diluant semblent décolorés.
· Ne pas utiliser la seringue si l'une de ses parties est endommagée.
|
|
|||||
|
Etape 1. Visser le piston à la seringue et fixer l'aiguille · Retirez le piston (partie 2) de l'emballage. · Vissez la tige du piston au bout de la seringue pré-remplie (côté opposé à l'aiguille) jusqu'à ce que le joint en plastique commence à tourner dans la seringue. (Figure A) · Ne pas tordre ou tirer vers l'arrière la tige du piston une fois qu'elle a été fixée à la seringue. · Sans retirer le capuchon de l'aiguille, tournez l'aiguille vers la droite (dans le sens des aiguilles d'une montre) pour vous assurer qu'elle est bien fixée. (Figure B) · Ne pas retirer le capuchon de l'aiguille avant d'être prêt à injecter. |
Figure A : Visser la tige du piston
Figure B : Vérifier la fixation de l'aiguille |
||||
|
Etape 2. Libération du diluant · En tenant la seringue à la verticale, libérer le diluant en poussant lentement le piston jusqu'à ce que le joint mobile séparant les 2 chambres atteigne la ligne bleue au milieu de la seringue. Vous devriez voir le diluant s'écouler dans la chambre intérieure au-dessus de la ligne bleue. (Figure C) · Ne pas pousser le piston trop rapidement et ne pas dépasser la ligne bleue afin de ne pas provoquer des fuites. · Ne pas retirer pas le piston à nouveau. |
Figure C : Libérer le diluant |
||||
|
Etape 3. Homogénéisation de la suspension · Taper légèrement la seringue contre la paume de votre main pour mélanger la poudre et le diluant aussi longtemps que nécessaire pour obtenir une suspension homogène et de couleur blanche. (Figure D) · Remarque : Si des particules collent au bouchon pendant le mélange, délogez-les en tapotant doucement la seringue avec votre doigt. · Ne pas secouer afin d'éviter la formation de bulles. · Utiliser immédiatement après le mélange car la suspension forme un dépôt très rapidement après la reconstitution. Important : La suspension ainsi obtenue doit être homogène et de couleur blanche (lactescente) avant de procéder à l'injection. |
Figure D : Taper légèrement la seringue contre la paume de main pour uniformiser la suspension |
||||
|
Etape 4. Retirer le capuchon de l'aiguille · Oter le capuchon de l'aiguille en le tirant droit vers le haut. · Ne pas tordre le capuchon de l'aiguille. · Amorcez la seringue en poussant le piston vers le haut jusqu'à ce que tout l'air ait été expulsé de la seringue. |
Figure E : Tirez vers le haut pour retirer le capuchon de l'aiguille |
||||
|
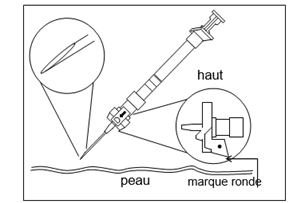
Etape 5. Injection · La seringue est maintenant prête pour l'injection. Utiliser immédiatement car la suspension se stabilise très rapidement après la reconstitution. ·Au moment de l'injection, vérifiez la direction du dispositif de sécurité (avec une marque ronde pointant vers vous) et injectez tout le contenu de la seringue par voie sous-cutanée ou intramusculaire comme vous le feriez pour une injection normale (Figure F).
Figure F : Injection - |
|||||
|
Etape 6. Activer le système de sécurité · Lorsque l'injection est terminée, retirez l'aiguille du patient. Activez immédiatement le dispositif de sécurité en poussant le capuchon protecteur vers le haut juste en dessous de la flèche jusqu'à ce qu'un « CLIC » soit entendu ou ressenti et que l'aiguille soit complètement recouverte. (Figure G) |
Figure G : Activer le système de sécurité |
||||
|
Etape 7. Jeter la seringue · Jetez l'appareil usagé dans le contenant approprié conformément à la réglementation en vigueur.
|
|||||
Des informations détaillées sur l'utilisation de la seringue pré-remplie et la reconstitution ce produit sont disponibles en scannant ce QR Code avec un smartphone.
Fréquence d'administration : les injections seront renouvelées toutes les 26 semaines (6 mois).

-
Enantone lp 30mg poudre + solvant pr susp inj 1
P
Prix : 462,05€ Taux de remboursement : 100%